
大麻和大麻素在临床口腔颌面外科的使用:范围综述
引言
大麻的使用已有数千年的历史,关于其医药用途的首次记录出现在公元400年左右[1]。起初,大麻的使用在美国不受管制,直到1937年,《大麻税法》出台,联邦首次对大麻的使用进行了限制。从那时起,立法一直是对用于娱乐或医疗目的的大麻的有力监管。1970年的《管制物质法》建立了第一个药物列表系统,将大麻与海洛因一起列入管制药物(表1)。然而,过去10年里,立法又有新变化,如今在35个州和华盛顿特区,允许21岁以上的成年人合法使用大麻治疗疾病[2-4](表1)。在剩下的15个州中,7个州(即乔治亚州、印第安纳州、爱荷华州、肯塔基州、德克萨斯州、弗吉尼亚州和威斯康星州)已将低浓度的∆-9-四氢大麻酚(THC)大麻二酚(CBD)油(最高5%的THC)的医疗用途合法化[2]。也就是说,如今只有8个州尚未将任何形式的大麻或CBD的医疗或娱乐用途合法化,鉴于部分法案尚未完善,到2021年底这一数字可能还会有所下降[2]。因此,大麻使用合法化的趋势为研究人员提供了一个了解医用大麻治疗潜力、以及更好地了解大麻娱乐用途产生的生理影响的机会。

Full table
具体来说,“大麻”一般指的是大麻植物的一部分,它含有最高浓度的主要精神活性化合物——THC,而“大麻植物”一词指的是所有桑科大麻植物[5,6]。大麻含有大约450种不同的化合物,包括60种大麻素[5,6]。THC和CBD是最常被研究的2种主要的大麻素。迄今为止,已经有数百项关于医用大麻和大麻素治疗癫痫发作、帕金森病、溃疡性结肠炎、认知功能障碍、阿片类药物使用障碍、急性和慢性疼痛等疾病方面的临床试验和研究[7]。然而,目前尚不清楚大麻在口腔颌面外科(OMFS)以及静脉注射(IV)镇静方面的研究情况,而静脉注射镇静是OMFS专业必不可少的组成部分。本研究试图对涉及OMFS中大麻使用情况的相关文献进行总结,包括其治疗结果和不良反应,并假设关于这一主题的研究可能较为匮乏。我们希望本研究能够成为未来研究OMFS中大麻使用情况的基础,尤其是在美国各地关于医用大麻使用的立法越来越宽松的情况下[2]。本文遵循PRISMA-ScR报告清单(详见https://joma.amegroups.com/article/view/5525/rc)撰写而成。
研究材料与研究方法
我们对大麻或大麻素与临床OMFS相关的文献进行了范围综述。该综述符合系统综述及荟萃分析扩展首选报告项目(PRISMA-ScR)报告检查表。
我们搜索了ClinicalTrials.gov、PubMed和Web of Science数据库中2021年1月11日以前的研究。搜索时使用了关键词,包括口腔外科*、颞下颌关节、牙槽骨、正颌外科、拔牙、牙科、牙科和大麻*、四羟基*、大麻。如果有MeSH术语,也会使用。评估大麻素或大麻与口腔手术关系的研究也被考虑纳入(图1)。我们排除了非英文撰写的论文、涉及动物模型的论文和没有干预手段的论文。题目和摘要由两位独立的研究人员(LY Tang和AR Emery)在2021年10月1日—11日进行筛选,并由作者(J Wang)审查和确定是否存在不一致之处。虽然上述方案是事先设计好的,但没有进行正式的方案登记。
临床试验的结果变量包括临床试验编号、研究名称、主要研究者(PI)姓名/作者姓名、PI专业、研究主题、研究类型、样本量、研究开始日期、研究结束日期、研究赞助商、主要结果和ClinicalTrials.gov上报告的结果。非临床试验的结果变量包括研究名称、作者、研究主题、研究类型、样本量、接受发表的日期、干预措施、主要成果和研究结果。不符合纳入标准的研究被排除。本研究中的数据是公开的,因此不需要机构审查委员会的批准。
结果
确定了11项符合纳入标准的研究,其中2项研究出自同一篇文献[8]。有7项前瞻性研究,包括4项临床试验(表2)和3项未注册为临床试验的随机对照试验(RCTs)。此外,还有4项观察性研究(即回顾性队列研究)(表3)。这些研究涉及的主题包括拔牙后急性疼痛、颞下颌关节疼痛和肌筋膜疼痛、拔牙窝的伤口愈合、静脉镇静的麻醉要求、静脉镇静的生理反应和观察,包括心血管反应。样本量从10到151例患者不等。其中共有2项研究发现大麻素可改善疼痛[9,10],同时有2项研究未能证明大麻素可改善疼痛[11,12]。此外,3项研究报告称,大麻素对生命体征有不利影响[8,13,14]。另一项研究指出,大麻素使用者的麻醉药需求增加[15]。最后,有1项研究报告称,大麻素和非大麻素使用者在拔牙后的术后愈合方面没有差异[16]。

Full table
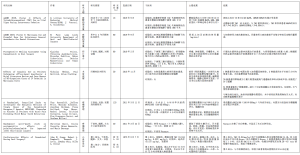
Full table
讨论
我们的研究说明了当前大麻和大麻素应用于OMFS中的研究概况。正如我们对主要结果的假设,符合条件的研究数量不多,最终确认的研究共有11项。在未来,有关大麻素在口腔手术中应用的研究可能会更加普遍,对于在治疗中合法使用了大麻素的患者群体来说,这一点至关重要。我们的次要结果主要在于各项研究的结果,详见表2、表3,后续也会对此进行详细解释。
大麻素的给药途径
大麻素已被配制为可通过各种途径给药,包括吸入、口服、舌下含服、静脉注射、肌内注射和局部使用[17,18]。然而,在本文纳入的7项前瞻性研究中[8-12,16,19],1项研究使用静脉注射THC[8],2项使用局部CBD[10,16],其余研究的大麻素给药途径为口服。一项正在进行的临床试验目前正处于招募阶段,计划给药方式为舌下含服CBD和大麻油1分钟,然后吞咽[19]。使用静脉注射THC的研究评估了其对心血管系统的影响[8]。与口服大麻素不同,舌下含服和静脉注射不经过肝脏代谢,从而避免了首过消除,避免了活性大麻素化合物生物利用率的降低。4项观察性研究根据THC毒理学阳性或自我报告的大麻使用情况纳入患者,大麻最有可能通过吸入或口服进入体内,尽管在研究中没有具体说明。大麻的给药途径对于评估药物效果而言很重要,特别是考虑到整个文献中给药途径的多样性[12]。鉴于OMFS手术部位(即疼痛源)与口服、舌下含服、局部应用或经口吸入等给药途径应用到的部位相近,OMFS术野特别容易受到给药途径的影响[12]。未来的研究重点可能在于更好地描述大麻素的不同给药方式会如何影响OMFS患者,并探索哪种给药途径对特定手术最有效。
疼痛
在OMFS文献中发现的11项以大麻和大麻素为重点的研究中,有6项评估了疼痛的缓解。以前的研究表明,大麻素可能具有镇痛、抗焦虑、解痉、抗炎和抗惊厥的特性[20]。阿片类药物的流行为寻找其他止痛方式提供了动力,使许多人开始考虑使用大麻素[21]。拔牙是历来最为常见的OMFS手术之一,是令许多患者感到不适、需要处方止痛药的原因,也是一个潜在可应用大麻素的领域[22]。2011年,Bacci等人进行了一项分阶段的口服研究,对接受第三磨牙拔牙术后使用300mg Normast(即十六酰胺乙醇,一种大麻素受体配体)与不使用Normast的患者进行比较[9],根据视觉模拟量表(VAS)得出结论,Normast改善了术后疼痛。然而,参与者退出率和术后非甾体抗炎药(NSAID)使用的异质性严重限制了该研究对疼痛的客观评估。该研究还发现,与对照组相比,Normast组的水肿发生延迟,这表明Normast可能延迟拔牙后的水肿形成。目前,一项III期研究在比较2种不同浓度下,口服CBD滴剂与泰诺和布洛芬以及安慰剂对于拔牙后患者的止痛效果[23]。这项研究可能阐明CBD是否可以替代NSAID和泰诺,成为拔牙后的辅助用药。未来需要开展前瞻性研究并努力提高研究方案的合规性,才能对大麻素治疗拔牙后牙痛的潜力得出更有力的结论。
2011年,一项随机对照试验比较了在下颌第三磨牙手术拔牙前给予GW842166(一种实验性大麻素和选择性CB2激动剂)与布洛芬和安慰剂的效果。研究未发现GW842166有镇痛作用[12]。研究者将没有观察到GW842166的镇痛作用归因于血药浓度没有达到治疗剂量,这可能是由于药物与血浆蛋白结合率高,在以前的大鼠实验和人体研究中也观察到相同的现象。提高药物剂量或通过其他不同途径给药(例如,肌内注射或静脉注射),可能会增加血药浓度,从而达到治疗剂量。研究者还建议增加药物对其CB2受体的暴露时间,产生药理效应。因为GW842166是选择性CB2受体激动剂,缺乏CB1受体激动剂的精神作用,可能是首选药物,值得更多研究。2012年,开展了一项对比下颌第三磨牙拔除术前使用另一种实验性大麻素AZD1940(CB1和CB2激动剂)与安慰剂和萘普生的研究[11]。该研究的结论是,AZD1940并没有减少术后疼痛。尽管这些实验性大麻素的作用缺乏令人信服的证据,但仍有希望通过其他给药途径和剂量来提高其疗效。此外,随着更多阿片类药物的发现,关注受体的选择性(即CB1与CB2)也可能改变治疗效果,以及减少潜在的不良反应。
OMFS以外的其他外科专业也考虑用大麻素来治疗急性疼痛。例如,2020年对8项RCTs和4项观察性研究的荟萃分析[24]评估了大麻素对各种类型手术(即心脏外科、普通外科、神经外科、骨科、泌尿外科、血管外科和2项拔牙RCTs)后疼痛的缓解作用[11,12]。他们发现,在镇痛剂中加入大麻素并不能改善外科手术后的急性疼痛。同样,2020年,一项对6项使用大麻素治疗外科手术后急性疼痛的随机对照试验进行的荟萃分析[25],纳入了2项关于拔牙的RCT[11,12],发现肌肉注射大麻素对主观疼痛评分有轻微但有统计学意义的改善,而口服大麻素的改善程度则较小。关于大麻素对缓解术后急性疼痛的作用,这些研究的结果不一致,需要进行更多的高水平研究,如随机对照试验等,以得出更有说服力的结论。鉴于不同手术类型的疼痛体验也不同,未来对OMFS手术中大麻素应用的研究,对从事OMFS的医务人员而言最有参考价值。
针对大麻和大麻素对慢性疼痛的缓解作用,包括癌性疼痛和非癌性疼痛,也开展过研究[26]。2015年对慢性非恶性神经病理性疼痛开展的系统综述发现,大麻素可能在其他疼痛治疗方式无效时,提供有效的镇痛[27]。2019年的一项临床试验评估了将大麻软膏涂抹在双侧咬肌皮肤上的效果,研究发现与安慰剂相比,肌筋膜疼痛得到缓解,表面肌电图(sEMG)显示颌骨肌肉活动明显减少[10]。一项正在进行的调查颞下颌关节和肌筋膜疼痛(通常为慢性疼痛)的临床试验将有望使人们深入了解大麻素对这种疼痛的潜在治疗作用[19]。颞下颌关节疼痛和肌筋膜疼痛是OMFS中很难控制的疼痛。研究者希望,对大麻素的持续关注能够阐明大麻素是否对颞下颌关节疼痛和肌筋膜疼痛具有镇痛作用[28]。
麻醉药需求量
与娱乐性大麻使用者相关的静脉麻醉药的需求量也已得到研究。2019年的一项回顾性队列研究,将自称是大麻使用者与非大麻使用者的患者在静脉镇静下进行拔牙后的麻醉药需求量进行了比较,发现大麻使用者丙泊酚需求量平均值较高(单位:mg/min)[15]。这些发现表明,OMFS患者的药代动力学受大麻使用情况影响。因此,OMFS术者在麻醉前的评估中对大麻的使用进行量化,可能能够预测每位患者的术中镇静药物需求,甚至可确定患者是否适合门诊手术。
生命体征、心血管影响和围术期观察
THC和大麻素对正常生理的影响,特别是对心血管的影响,对OMFS术者来说也很重要。2019年一项针对成年患者的回顾性队列研究比较了THC在静脉注射镇静剂(咪达唑仑)和静脉注射芬太尼期间对生命体征的影响。如果患者的尿液THC检测结果呈阳性,则将其置于实验组;如果检测结果呈阴性,则将其置于对照组[13]。与THC检测呈阴性的组别相比,检测呈阳性的患者在手术后10分钟内的平均动脉压百分比变化和心率百分比变化都有统计学意义。然而,呼吸频率没有明显变化。这些发现表明,与不使用大麻的患者相比,使用大麻的患者对静脉注射镇静药的生理反应可能不同。
Gregg等人(1976年)的另一项研究调查了大麻酚在口腔手术中对心血管的影响[8]。他们比较了手术前静脉注射THC与地西泮和安慰剂,发现接受较高剂量THC(即0.044mg/kg,而非0.022mg/kg)的患者心率峰值较高,在用药后4~8分钟出现晕厥样低血压发作,并在用药25分钟后出现血压升高。他们还注意到,1例接受0.044 mg/kg THC的患者在用药后1小时内,其术前心律失常的情况有所缓解。相比之下,0.022 mg/kg组的4例患者的术前心律失常发生率有所增加。Gregg等人还对10例接受静脉全身麻醉的拔牙患者进行了回顾性研究,发现那些在手术后72小时内接受使用THC的患者在麻醉结束后平均38分钟内表现出持续的术后心动过速,对照组则为7分钟。随着大麻和大麻素越来越多地用于娱乐和医疗目的,这些观察也成为重要的参考因素。了解大麻素的生理影响有助于医护人员为患者提供咨询,也有助于准备应对因接触大麻而引起的任何生命体征扰动。
其他研究则关注使用大麻的患者在围术期的变化。Mechas等人(2018年)对50例静脉镇静病例开展的回顾性队列研究指出,26例患者因哮喘或改善肺部听诊音之需,而需要在术前服用沙丁胺醇[14]。他们还报告说,31例患者接受了格隆溴铵,以防止因分泌物带来的各种意外事件,如误吸、支气管痉挛、喉痉挛等。地西泮减少了术中其他药物的使用,如丙泊酚、芬太尼和氯胺酮。在排除了3例在计划手术前几小时内吸食大麻的患者后,研究者主张将择期手术推迟到患者最后一次吸食大麻的24小时后,确保可以获得知情同意。他们还主张在手术中和手术后对心血管和呼吸系统进行更仔细的监测。最后,他们报告称,大麻的止吐作用在吸食后短暂出现,而在术后经过24小时或更长时间后,止吐作用则不复存在。了解这些生理学趋势,能够让从事OMFS的医护人员更好地管理大麻使用者的生理紊乱状况,以保证患者安全。往后的研究可能会寻求量化,将所使用的大麻量与观察到的生理紊乱的量联系起来。
伤口愈合
大麻素也被证明具有免疫调节作用,它可以抑制白细胞介素-6(IL-6),IL-6可以上调小胶质细胞中抗炎反应通路[29]。Puisys等人在2019年的一项研究中发现,拔牙后使用口服阿莫西林和洗必泰冲洗液与那些在口内和口外使用植物大麻素-大麻二酚凝胶与洗必泰冲洗液的患者相比,在结果(即疼痛、肿胀强度、牙槽骨炎、对术后愈合的耐受性和总体满意度评估)上没有区别[16]。这项研究表明,大麻素和抗生素对拔牙后的愈合有类似的影响。然而,这项研究可能因两组都使用洗必泰冲洗剂而受到干扰,这解释了为什么两组的结果相似。大麻素具有抗炎作用的主张也值得研究,但需要针对大麻素及对照组(如抗生素)进行更有力的头对头比较研究,进行验证。
使用大麻的风险
尽管最近实现了合法化,但大麻的医疗用途仍然存在争议。Volkow等人(2014年)称,短期的不利影响包括记忆力受损、运动协调能力受损、判断力改变、妄想和精神病[30]。长期影响包括改变大脑发育和认知障碍[30]。长期使用大麻还可能导致药物依赖,9%的大麻使用者和17%从青少年时期开始使用大麻的人最终会上瘾[30]。此外,大麻的四氢大麻酚含量已从20世纪80年代的3%左右,稳步上升到2012年的12%,这可能导致更多的急诊病例[17]。另外,大麻可能与其他止痛药或麻醉药产生复杂的药物相互作用,而这些相互作用的确切机制仍不清楚。这些潜在的风险必须在替代治疗的背景下加以考虑,如阿片类药物,它也有成瘾的风险。将大麻合法用于医疗用途可能会降低阿片类药物的使用率和死亡率,尽管这一想法还需要进一步的研究[21]。
研究的局限性
本研究的局限性之一是只纳入了用英语书写的研究。此外,研究质量也是局限性之一:11项研究中有4项是观察性研究,其余7项RCTs的样本量相对较小(从10到151例患者不等)。患者退出及没有遵守预设的试验方案也对研究结果有一定影响[9,14]。
结论
总的来说,评估大麻和大麻素在OMFS中作用的研究数量极少,我们在英文文献中只找到了11项研究。其中2项研究发现大麻素可改善疼痛[9,10],2项研究未能证明大麻素可改善疼痛[11,12],3项研究报告大麻素对生命体征有不利影响[8,13,14],1项研究报告大麻素使用者的麻醉药需求量增加[15],1项研究报告大麻素和非大麻素使用者拔牙后的术后愈合没有差别[16],还有1项研究正在进行[23]。鉴于过去10年来,法律放宽大麻娱乐性和医疗性用途的使用,预计更多的患者在与OMFS医护人员沟通之前已经尝试过或积极使用大麻素。未来的研究对于了解这些物质和药物的作用及潜在的治疗效果,特别是它们的临床意义来说,是至关重要的。本研究有望为指导未来旨在阐明大麻素对OMFS可能产生的作用和影响的研究奠定基础。
Acknowledgments
Funding: None.
Footnote
Reporting Checklist: The authors have completed the PRISMA-ScR reporting checklist. Available at https://joma.amegroups.com/article/view/10.21037/joma-21-7/rc
Conflicts of Interest: The authors have completed the ICMJE uniform disclosure form (available at https://joma.amegroups.com/article/view/10.21037/joma-21-7/coif). JW serves an unpaid editorial board member of Journal of Oral and Maxillofacial Anesthesia from August 2021 to July 2023. The other authors have no conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
*,截词符,代替一个词当中有可能产生变化的字母,例如原文中使用surg*可以检索到surgery、surgical等,防止漏检。
References
- Bridgeman MB, Abazia DT. Medicinal Cannabis: History, Pharmacology, And Implications for the Acute Care Setting. P T 2017;42:180-8. [PubMed]
- State medical marijuana laws. National Conference of State Legislatures. Available online: https://www.ncsl.org/research/health/state-medical-marijuana-laws.aspx (accessed January 18, 2021).
- Pacula RL, Smart R. Medical Marijuana and Marijuana Legalization. Annu Rev Clin Psychol 2017;13:397-419. [Crossref] [PubMed]
- Map of marijuana legality by state. DISA. Available online: https://disa.com/map-of-marijuana-legality-by-state. Published 2021. Accessed February 1, 2021.
- Horvath C, Dalley CB, Grass N, et al. Marijuana Use in the Anesthetized Patient: History, Pharmacology, and Anesthetic Considerations. AANA J 2019;87:451-8. [PubMed]
- Sawler J, Stout JM, Gardner KM, et al. The Genetic Structure of Marijuana and Hemp. PLoS One 2015;10:e0133292. [Crossref] [PubMed]
- Pauli CS, Conroy M, Vanden Heuvel BD, et al. Cannabidiol Drugs Clinical Trial Outcomes and Adverse Effects. Front Pharmacol 2020;11:63. [Crossref] [PubMed]
- Gregg JM, Campbell RL, Levin KJ, et al. Cardiovascular effects of cannabinol during oral surgery. Anesth Analg 1976;55:203-13. [Crossref] [PubMed]
- Bacci C, Cassetta G, Emanuele B, et al. Randomized split-mouth study on postoperative effects of palmitoylethanolamide for impacted lower third molar surgery. ISRN Surg 2011;2011:917350. [Crossref] [PubMed]
- Nitecka-Buchta A, Nowak-Wachol A, Wachol K, et al. Myorelaxant Effect of Transdermal Cannabidiol Application in Patients with TMD: A Randomized, Double-Blind Trial. J Clin Med 2019;8:1886. [Crossref] [PubMed]
- Kalliomäki J, Segerdahl M, Webster L, et al. Evaluation of the analgesic efficacy of AZD1940, a novel cannabinoid agonist, on post-operative pain after lower third molar surgical removal. Scand J Pain 2013;4:17-22. [Crossref] [PubMed]
- Ostenfeld T, Price J, Albanese M, et al. A randomized, controlled study to investigate the analgesic efficacy of single doses of the cannabinoid receptor-2 agonist GW842166, ibuprofen or placebo in patients with acute pain following third molar tooth extraction. Clin J Pain 2011;27:668-76. [Crossref] [PubMed]
- Lillian D, Vorrasi J, Kolokythas A. Effects of tetrahydrocannabinol (THC) use on vital signs during intravenous sedation. J Oral Maxillofac Surg 2019;77:e64-5. [Crossref]
- Mechas N, Deitrick P, Fielding A. Effects of cannabis use on patients undergoing office-based anesthesia: A brief literature review and case report of 50 outpatient cases of IV sedation in marijuana ssers. Oral Surg Oral Med Oral Pathol Oral Radiol 2018;126:e241-2. [Crossref]
- Pace M. Marijuana use and propofol dose for intravenous general anesthesia for dental extractions. J Oral Maxillofac Surg 2019;77:e65. [Crossref]
- Puisys A, Auzbikaviciute V, Kubilius R, et al. T. Postoperative healing assessment using cannabinoids in oral surgery. EC Dent Sci 2019;18:569-75.
- Peters J, Chien J. Contemporary routes of cannabis consumption: A primer for clinicians. J Am Osteopath Assoc 2018;118:67-70. [PubMed]
- How marijuana is consumed. Drug Policy Alliance. 2015:1. Available online: http://www.drugpolicy.org/facts/drug-facts/marijuana/how-marijuana-consumed
- Reeve G. Comparison of cannabinoids to placebo in management of TMJ pain and myofascial pain in the TMJ region | NCT04298554. Available online: ClinicalTrials.gov. 2020.
- Vučković S, Srebro D, Vujović KS, et al. Cannabinoids and Pain: New Insights From Old Molecules. Front Pharmacol 2018;9:1259. [Crossref] [PubMed]
- Chihuri S, Li G. State marijuana laws and opioid overdose mortality. Inj Epidemiol 2019;6:38. [Crossref] [PubMed]
- Nalliah RP, Sloss KR, Kenney BC, et al. Association of Opioid Use With Pain and Satisfaction After Dental Extraction. JAMA Netw Open 2020;3:e200901. Erratum in: JAMA Netw Open 2020;3:e204463. [Crossref] [PubMed]
- Derefinko KJ, Abidi AH. Surgery with Alternative Pain Management (SWAP): Analgesic Effects of Cannabidiol for Simple Tooth Extractions in Dental Patients | NCT04271917. Available online: ClinicalTrials.gov. 2021.
- Abdallah FW, Hussain N, Weaver T, et al. Analgesic efficacy of cannabinoids for acute pain management after surgery: a systematic review and meta-analysis. Reg Anesth Pain Med 2020;45:509-19. [Crossref] [PubMed]
- Gazendam A, Nucci N, Gouveia K, et al. Cannabinoids in the Management of Acute Pain: A Systematic Review and Meta-analysis. Cannabis Cannabinoid Res 2020;5:290-7. [Crossref] [PubMed]
- Romero-Sandoval EA, Kolano AL, Alvarado-Vázquez PA. Cannabis and Cannabinoids for Chronic Pain. Curr Rheumatol Rep 2017;19:67. [Crossref] [PubMed]
- Boychuk DG, Goddard G, Mauro G, et al. The effectiveness of cannabinoids in the management of chronic nonmalignant neuropathic pain: a systematic review. J Oral Facial Pain Headache 2015;29:7-14. [Crossref] [PubMed]
- Ahmad M, Schiffman EL. Temporomandibular Joint Disorders and Orofacial Pain. Dent Clin North Am 2016;60:105-24. [Crossref] [PubMed]
- Mechoulam R, Peters M, Murillo-Rodriguez E, et al. Cannabidiol--recent advances. Chem Biodivers 2007;4:1678-92. [Crossref] [PubMed]
- Volkow ND, Baler RD, Compton WM, et al. Adverse health effects of marijuana use. N Engl J Med 2014;370:2219-27. [Crossref] [PubMed]

王淼
四川大学华西口腔医院麻醉科主任医师,现任中华口腔医学会口腔麻醉学专委会副主任委员,四川省临床麻醉质控中心专家,四川省医师协会委员。自1990年毕业于华西医科大学后,一直从事口腔颌面外科手术麻醉、急救及舒适化牙科相关工作至今。主编《唇腭裂手术麻醉》等2部专著,参编多部学术专著,发表多篇学术论文。《华西口腔医学杂志》《国际口腔医学杂志》审稿专家。2018年被四川省卫计委评为四川省首届“临床技能名师”。(更新时间:2022-05-13)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Tang LY, Emery AR, Wang J. Marijuana and cannabinoid use in clinical oral and maxillofacial surgery: a scoping review. J Oral Maxillofac Anesth 2022;1:6.




